Termin 4
Läkemedels Kemi

Exempel på några vanliga läkemedelstermer:
| Singularisform | Pluralisform |
Betydelse |
| Adrenergikum | Adrenergika | Läkemedel som stimulerar adrenerga receptorer |
| Analgetikum | Analgetika | Läkemedel mot smärta |
| Anestetikum | Anestetika | Bedövningsmedel |
| Antiadrenergikum | Antiadrinergika | Läkemedel som blockerar adrenerga receptorer |
| Antibiotikum | Antibiotika | Mikroorg.prod. ämne som hindrar andra mikroorg. tillväxt |
| Antidepressivum | Antidepressiva | Läkemedel mot depression |
| Antiepileptikum | Antiepileptika | Läkemedel mot epilepsi |
| Antikolinergikum | Antikolinergika | LM som blockerar kolinerga receptorer |
| Anxiolytikum | Anxiolytika | Ångestlösande medel |
| Ataraktikum | Ataraktika | Orosdämpande medel |
| Diuretikum | Diuretika | Urindrivande medel |
| Farmakon | Farmaka | Läkemedel |
| Hypnotikum | Hypnotika | Sömnmedel |
| Kemoterapeutikum | Kemoterapeutika | Syntetiskt LM mot infektioner (oxå LM mot tumorsjukd.) |
| Kolinergikum | Kolinergika | LM som stimulerar kolinerga receptorer |
| Neuroleptikum | Neuroleptika | LM mot psykoser |
| Psykofarmakon | Psykofarmaka | LM mot psykiska sjukdomar |
| Sedativum | Sedativa | Lugnande läkemmedel |
| Spasmolytikum | Spasmolytika | Kramplösande läkemedel |
| Tymoleptikum | Tymoleptika | Stämningshöjande medel |
Farmakofor: Kemisk beskrivning av de sammantagna delar som kännetecknar aktivitet vid ett visst biologiskt verkningsställe (receptor). Ej reell molekyl! Kan beskrivas matematiskt.
Farmakoformodell: Arbetsmodell/hypotes baserad på rådande kunskap. Struktur-aktivitet för läkemedel med samma aktivitet.
Receptormodell: Komplementärt beskriven av farmakoforen. Proteinets bindningsställe är utgångspunkten, t.ex. hydrofob ficka, vätebindningsdonator.
Enzymklassificering:
| Transferaser |
- Aminotransferaser - Transacetylaser - Fosforylaser |
| Oxidoreduktaser |
- Oxidaser - Dehydrogenaser - Reduktaser |
| Ligaser |
- Syntaser - Karboxylaser |
| Hydrolaser |
- Esteraser - Glykosidaser - Peptidaser/proteaser |
| Lyaser |
- Dekarboxylaser - Aldolaser - Hydrataser |
| Isomeraser |
- Racemaser - cic-trans-Isomeraser |
Exempel på läkemedel som är reversibla enzymhämmare:
| Läkemedel | Enzym som hämmas | Klinisk användning |
| Kaptopril | Angiotensinkonvertas | Antihypertensivum |
| Indinavir | HIV-proteas | Mot HIV-infektion |
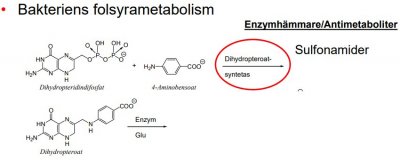
| Trimetoprim | Dihydrofolatreduktas | Antibakteriellt medel |
| Aciklovir | Viralt DNA-polymeras | Antiviralt medel |
| Norfloxacin | DNA-gyras | Antibakteriellt medel |
| Atorvastatin | HMG-CoA-reduktas | Serumlipidsänkare |
Exempel på läkemedel som är irreversibla enzymhämmare:
| Läkemedel | Enzym som hämmas | Klinisk användning |
| Omeprazol | H+, K+ -ATPas | Mot magsår |
| Karbidopa | Dopadekarboxylas | Antiparkinson |
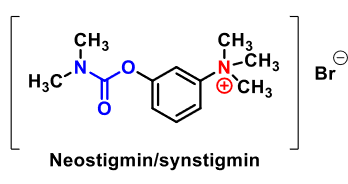
| Synstigmin | Acetylkolinesteras | Mot glaukom och myastenia gravis |
| Betalaktam-antibiotika | Transpeptidaser | Antibakteriella medel |
| Vigabatrin | GABA-transaminidas | Antiepileptikum |
ANTECKNINGAR:
Inläsningsanvisningar till boken "Läkemedelskemi 4:e (och 3:e) upplagan"
Kapitel 2, kunna redogöra för/tillämpa:
1. Den principiella skillnaden mellan rationella kemiska namn, generiska namn och produkt/specialitetsnamn
- Rationella kemiska namn: IUPAC-namn
- Generiska namn: begagnat neutralnamn
- Produkt/specialitetsnamn (prepparatnamn): enskilda firmans egendom, betecknar visst fabrikat av substansen eller substanskombinationen.
2. Hur generiska namn vanligen konstrueras, särskilt vad gäller syror, salter och estrar.
Generiska namn bygger i större eller mindre utsträckning på stavelser i det rationella kemiska namnet. Ofta används första stavelser/ ändelser för att markera vilken farmakologisk grupp ämnet tillhör.
Latiniserade namn på LM-substanser ändas i allmänhet på -um. Annat namnskick gäller dock syror(-syra), estrar(-at, -oat) och salter(-id).
3. Användningen av fasta prefix och suffix för att markera LM-substansers farmakologiska hemvist.
Fasta för- stavelser/ ändelser markerar vilken farmakologisk grupp ett visst ämne tillhör
-> Betecknar tillhörighet av viss kemisk och farmakologisk karaktär, exempelvis:
| -barbital | Sömnmedel tillh. barbitursyraserien |
| -tiazid | Diuretikum |
| -kain | Lokalbedövningsmedel (härlett fr. kokain) |
| -toin | Hydantoiner (i regel antiepileptika) |
| Sulfa- | Antibakteriella sulfonamider |
| Cef- | Cefalosporiner |
| -cillin | Penicillinderivat |
| -cyklin | Tetracyklinderivat |
4. Innebörden av akronymen INN efter ett generiskt namn.
INN- International Non-proproetary Names
- INN står för International Non-Proprietary Names och baseras på att man namnger farmaceutiska substanser utefter deras generiska namn. Syftet med INN är man ska namnge en substans på samma sätt oavsett vilket land man befinner sig i. Man ser ibland beteckningarna pINN och rINN, där p står för proposed och r för recommended. pINN-namnen är att betrakta som namnförslag som utsänts på remiss till olika länder för ett eventuellt godkännande som INN-namn.
5. Vilken farmakopé som för närvarande gäller i Sverige.
SLS- Sveriges Läkemedels Standard, utges av Läkemedelsverket
- Etablerade läkemedel kommer förr eller senare in i en farmakopé. En farmakopé innehåller bland annat monografier över läkemedelssubstanser. En sådan monografi inleds med en beskrivning av ämnet i olika termer: kemiskt namn, strukturformel, utseende, löslighet m.fl. Därefter följer vanligen ett avsnitt om hur ämnet identifieras. Sverige använder sig av farmakopén Pharmacopoea Europea, Ph. Eur. Eftersom utarbetande av monografier i Europafarmakopén är en omständlig process, har man kompletterat farmakopén med en serie monografier som kallas för SLS (Svensk Läkemedelsstandard).
Kapitel 4, kunna redogöra för/tillämpa:
1. Vilka typer av biologiska makromolekyler som kan tjäna som målmolekyler för läkemedel.
Makromolekylära måltavlor för läkemedel:
- Lipider
- Kolhydrater
- Proteiner
- Receptorer
- Enzymer
- Nukleinsyror (cytostatika, antibakteriella och antivirala LM)
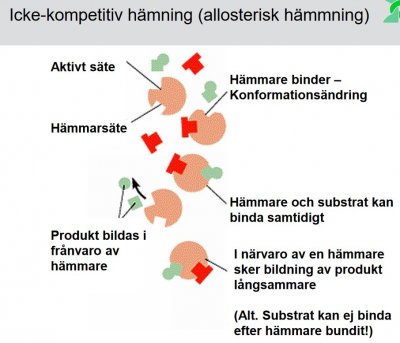
2. Begreppen reversibla och irreversibla enzymhämmare.
Typer av enzymhämmare:
Reversibla:
- Icke-kompetitiv (Allosterisk hämmare)
- Kompetitiv
- Substratanaloger
- Övergångstillståndsanaloger ("Transitionstate" analoger)
- Kvasisubstrat
Reversibla enzymhämmare är vanligast. De är ofta substratanaloger och övergångstillståndsanaloger (tex. indinavir: HIV-proteashämmare)
Irreversibla:
- Mekanism-baserade (Kcat -hämmare) (suicide substrate)
- Alkylerande/Acylerande substratanaloger
Irreversibel enzymhämning utnyttjar oftast substratlikhet för att genomgå samma katalytiska process som substratet. De är dessutom utrustade med någon ytterligare funktionell grupp som genom den enzymatiska omvandlingen ger upphov till ett reaktivt intermediat inne i aktiva centrum. Detta enzymbundna intermediat (I*) kan sedan reagera med enzymet eller co-faktorn och blockera aktiva centrum irreversibelt.

3. Begreppen substratanalog, transition stateanaloger, kvasisubstrat, alkylerande substratanaloger och kcat-hämmare.
Substratanalog: är kompetitiva inhibitorer och ockuperarsamma bindningsställe som sin analog.
Transition stateanaloger: är kemiska föreningar med en kemisk struktur som liknar övergångstillståndet för en substratmolekyl i en enzymkatalyserad kemisk reaktion.
Kvasisubstrat: är hämmare som ofta klassificeras under transitionstate rubriken, men som skiljer sig avsevärt och reagerar med enzymet under bildning av en reversibel, kovalent bindning.
Alkylerande substratanaloger: katalytiskt irreversibla hämmare utnyttjar oftast en substratlikhet för att genomgå samma katalytiska process som substratet. De är dessutom utrustade med någon ytterligare funktionell grupp, som genom den enzymatiska omvandlingen ger upphov till ett reaktivt intermediat inne i aktiva centrum. Detta enzymbundna intermediat (I*) kan sedan reagera med enzymet eller cofactorn och blockera aktiva centrum irreversibelt.
- Ämnen i gruppen alkyleringsmedel fungerar som cytostatiska medel genom att bindas kovalent till essentiella cellkomponenter, särskilt DNA, och därmed förhindra fortsatt celldelning.
Kcat-hämmare: även kallad självmordshämning (suicide inactivation). Har fått stor betydelse för möjligheterna att rationellt utforma irreversibla hämmare som uppvisar specificitet för ett visst enzym. Reaktiviteten är latent och specifik i och med att den framkommer först när hämmaren har genomgått en katalytisk omvandling mha ett visst enzym.
- genomgår samma inledade katalytiska process som det naturliga substratet, varvid en ny reaktiv intermediär bildas. Den reaktiva intermediären reagerar sedan kovalent med enzymet och blir irreversibelt blockerat. "Enzymet begår självmord genom att själv bidra till bildandet av hämmaren"
4. Den principiella verkningsmekanismen för ovanstående typer av enzymhämmare.
Den principiella verkningsmekanismer för ovandsående typer av enzymhämmare, är enzymernas analoga utseende och deras hämmande verkan på reaktionen.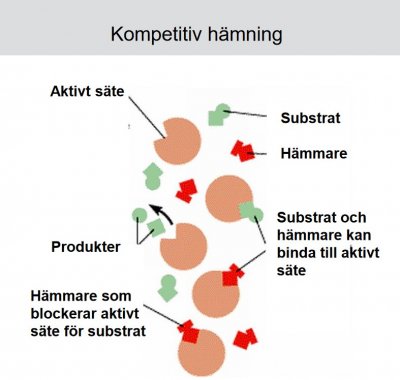
Kapitel 5, kunna redogöra för/tillämpa:
1. Skillnaden mellan strukturellt specifika och strukturellt ospecifika läkemedel.
Skillnaden mellan strukturellt specifika och strukturellt ospecifika läkemedel är att för strukturellt ospecifika läkemedel som allmänanestetika och vissa baktericider har man funnit en god korrelation mellan aktivitet och enkla fysikaliska parametrar som löslighet, ångtryck, fördelningskoefficient olja/vatten och ytaktivtet. I motsats till dessa uppvisar de flesta läkemedel hög strukturspecificitet, d.v.s. en liten förändring i molekylens struktur ger en stor förändring i aktivitet, och det finns ingen enkel korrelation med en enstaka fysikalisk-kemisk egenskap. Endogena signalsubstanser som acetylkolin, noradrenalin, och steroider har alltid hög strukturspecificitet.
- Ospecifika: verkan av generella anestetika (gaser såväl som intravenösa) beror sannolikt inte på interaktion med en enda väl definierad receptor, utan på inverkan av flera proteiner, särskilt jonkanaler som spänner över cellmembranen. Fördelningskoefficienten (P) mellan en organisk fas (oftast oktanol) och en vattenfas används ofta som en lätt mätbar parameter att korrelera med biologisk effekt, särskilt i kvantitativa struktur-effektsamband. Inom en homolog serie eller en grupp av analoger finner man ofta ett idealt värde på fördelningskoefficienten för maximal effekt, medan aktiviteten minskar för föreningar med högre eller lägre fettlöslighet.
- Specifika: fysiologiskt svar erhålls vid bindning och påverkan av makromolekylär struktur (receptor) i organismen. Närvaron av speciella kemiska grupperingar med inbördes väldefinierade lägen spelar en avgörande roll i denna interaktion.
t.ex. föreningarna amidefrin (adrenerg agonist) och sotalol (adrenerg antagonist/ β-receptorblockerare, med samma grupp i paraposition och dessutom isopropyl på kvävet på kvävet).

2. Vilka typer av bindningar som kan förekomma vid läkemedel-receptorinteraktionen.
Bindningstyper som förekommer och påverkar läkemedel-receptorinteraktionen:
1. Kovalenta
- Kovalenta bindningar relativt ovanliga, förekommer vid enzymhämning (särskilt hos parasiterande organismer, och när vissa anticancerläkemedel reagerar med t.ex. nukleinsyror). Förutom penicilliner och andra β-laktamer har ett par andra av de mest sålda läkemedlen detta verkningssätt (nämligen acetylsalicylsyra, som acetylerar en serinrest i cyklooxygenas-1, och omeprazol (Losec®) som hämmar H+, K+ -ATPas). Kan endast brytas genom enzymatisk inverkan eller genom en annan kemisk reaktion, exv. hydrolys. Funktionen hos receptorn kan även återvinnas genom nysyntes av proteinet.
- icke-kovalenta bindnigar skiljer sig från de kovalenta genom sina avsevärt lägre bindningsenergier och är därför reversibla vid normala temperaturer. Trots detta är de viktiga i biologiska system genom sin mångfald och sin precisa orientering i rymden. t.ex. när ett enzym binder reaktanterna i en enzymkatalyserad reaktion. Interaktionens styrka utvisas av jämviktskonstanten, oftast uttryckt som dissociationskonstanten Kd för receptor-ligandkomplexet.
2. Elektrostatiska
-(E=energi; r=avstånd mellan grupper)
a. mellan joner; E=1/r
b. mellan en jon och en inducerad dipol; E=1/r^4
c. mellan permanenta dipoler eller mellan en permanent och en inducerad dipol; E=1/r^6
De elektrostatiska krafternas kvantitativa omfattning är svåruppskattad, pga dess beroende av omgivningens dielektricitetskonstant. t.ex. en jon-jonbindning neutraliseras effektivt av jon-vatteninteraktionen i vattenlösning. På samma sätt som enzym-substratinteraktionen, sker läkemedel-receptor interaktionen i en till stora delar vattenfri miljö. Bindningen återföljs därmed av en avsevärd energiutveckling, upp till flera hundra kJ/mol när en ammoniumjon är inblandad. Trots den energikostsamma läkemedelsdehydratiseringen blir bindningen mer gynnsam mellan det joniserade läkemedlet och den motsatta laddningen i receptorn. (t.ex. jon-dipolbindning vid natriumjonens solvatisering i vatten jmf. m. dipol-dipolinteraktion hos en polariserad karbonylgrupps bindning till det fria elektronparet på en OH-grupp [O=C--O-HR]..krafterna är starkt avståndsberoende!)
3. Van der Waals/ dispersionskrafter (icke-polära interaktioner)
Svaga och ffa. kraftigt avståndsberoende (E=1/r^6). pga kraftiga fluktuationer i elektrontäthet hos opolära atomer och molekyler, som som inducerar dipoler i den opolära omgivningen (orsaken till ädelgasatomernas attraktion till varandra). Det "van der Wallsska kontaktavståndet": det optimala avståndet mellan atomerna där attraktionen är som starkast, och är alltså summan av de deltagande atomernas eller gruppernas karakteristiska van der Waals-radier. Trots de svaga krafterna, utgör de ett betydande bidrag i summeringen av en hel molekyl-molekylinteraktion. (t.ex. i kristallint kolväte bidrar varje metylengrupp med 8,4kJ/mol[sublimationsvärme], vilket för en kedja om tio metylengrupper blir hela 84kJ/mol)
4. Vätebindningar
Specialfall av dipol-dipolinteraktion, men pga sin speciella natur och stora betydelse behandlas denna separat.
- Uppkomer mellan två elektronegativa atomer som binds med olika avstånd till samma proton. Mycket vanlig bindningstyp och finns t.ex. mellan basparen i DNA. De flesta LM har möjlighet att delta i vätebindningar, och dessa har sannolikt stor betydelse i åtskilliga receptorbindningar (t.ex. metotrexat, inhibitor till dihydrofolatreduktas, utbildar flertal vätebindningar till enzymet).
5. Hydrofoba effekter
Icke-polära föreningar är hydrofoba pga att de ej kan utbilda dipolära bindningar med vatten och tenderar att istället samlas i aggregat och bilda egna faser.
Mycket viktig i i biologiska system, bl.a. avgörande för de fettrika membranens bibehållna strukturordning. Först minskar vattnets entropi (termodynamiskt ogynnsamt), men motarbetas då de hydrofoba molekylerna bildar en egen fas "avlägsnas från vattnet" och ökar vattnets entropi och den hydrofoba effekten förstärks av att dispersionskrafterna kan komma till uttryck.
LM-molekyl - lipofila delar pressas mot en lipofil receptoryta genom att vattenmolekyler samtidigt lämnar det lipofila området och därmed undgår den energikrävande ordnade strukturen. Interaktionstypen kallas, trots den egentliga yttre kraften (bl.a. vattnets ytspänning) som pressar ihop delarna, för hydrofob bindning. Denna kraft är proportionell mot den hydrofoba ytan hos den lösta molekylen (t.ex. mindre vattenlöslighet hos vanl. butanol jmf. m. tertiär butanol), en sfär är den kropp som exponerar minst yta i förh. till volymen.
3. Betydelsen av sterioisosteri vad gäller läkemedelseffekter.
Stereokemi:
Komplementära strukturer måste föreligga mellan ett läkemedel och dess bindningsställe i den makromolekylära receptorn. Därför är det uppenbart att interatomära avstånd i LM molekylen spelar en stor roll, särskilt de inbördes avstånden mellan funktonella grupper. I detta samanhang bör det påpekas att kolvätesgrupper också måste räknas som betydelsefulla, även om de inte är vad man normalt menar med funktionella grupper. exv. en cyklohexanring som i en molekyl sammanbinder två dominerande funktionella grupper kan svara för en mkt stor del av bindningsstyrkan genom att bindas till en komplementär kolväterik del i receptorn.
1. Optisk isomeri
Den olika fördelningen av atomer och grupper i rymden hos enantiomera molekyler har i regel ett stort inflytande på den biologiska aktiviteten. Detta är en naturlig reflektion av den allmänt förekommande dissymetrini biologiska system, där kirala molekyler är regel. Principen för olika farmakologisk aktivitet hos enantiomerer är okomplicerad och lika lätt att förstå som fenomenet att en vänsterhand inte passar i en högerhandske.
2. Cis-trans isomeri (äldre benämning: geometrisk isomeri)
Är egentligen ett specialfall av diastereoisomeri och kan förekomma vid både dubbelbindningar och ringsystem. Bland läkemedlen finns många exempel på farmakologisk aktivitet hos cis-/trans-isomerer. Av 4-(aminometyl)cyklohexankarboxylsyrans två stereoisomerer hämmar endast trans-formen, d.vs. tranexamsyra, plasminbindningen från plasminogen.
3. Konformationsisomeri (konformerer)
Isomerer med icke-identiska rymdstrukturer, som uppkomer genom rotation runt en eller flera enkelbindningar. Dessa konformerer står i snabb jmv m varandra och kan inte separeras vid normala temperaturer. Studeras med fysikaliska metoder som NMR, IR och mikrovågspektroskopi och mätningar av dipolmoment. Den röntgenkristallografiska bilden representerar en "utfrusen" konformer av en förening så som den föreligger i kristallform.
4. Fysikalisk-kemiska egenskaper av betydelse för läkemedlens absorbtion, distribution och eliminering.
Fysikalisk-kemiska egenskaper som påverkar läkemedel-målproteininteraktioner, lipo-/hydrofilisitetsbalansen, syra-basegenskaper och andra joniseringsegenskaper, rymdstruktur (form), elektronfördelning (som leder till att molekylens kontaktytor kan beskrivas) och kemisk reaktivitet. Både farmakodynamiken(aktiviteten vid verkningsstället) och farmakokinetiken, d.v.s. sådana fenomen som påverkar koncentrationen vid verkningsstället, främst absorbtion, distrubution och eliminering.
Absorbtion
- Upplösningshastigheten, beroende av LM kemiska natur. t.ex. ett salt av en karboxylsyra löses vanligtvis upp fortare än den kristallina syran själv. I salter har även motjonen stor betydelse för upplösningshastigheten (jmf skillnaden i upplösningshastigheten hos olika salter). LM absorbtion sker ospecifikt genom diffusion i oladdad form (membraner i tarmväggen, liksom övriga cellmembraner är fettartade och tillåter ej passiv penetretion av hydrofila föreningar t.ex. joniserad syra) och lipofila LM passerar lätt genom tarmmenbranen.
*Joniseringsegenskaper(inkl. syra-bas-egenskaper) samt lipofilicitet, spelar störst roll vid absorbtionen. (eftersom joniserade föreningar är dåligt fettlösliga kan inte heller läkemedel som är syror eller baser diffundera genom tarmväggen annat än i sin neutrala form [oladdad form]).
Förhållandet joniserad/icke-joniserad form för svaga syror och baser räknas lätt ut mha Henderson-Hasselbalchs ekvation: pH = pKa + log[bas] - log[syra]
Magsäcken (pH 1-3) -> Tolvfingertarmen (pH ~5) -> neutralt pH
Skillnader i pH avgör var absorbtionen äger rum! t.ex. svagt sura LM börjar absorberas redan i magsäcken.
*Diffusionen går i riktning mot den vätska vars pH är högre (7,4) än i magsäcken och duodenum. Det föreligger även relativt svaga baser fullständigt protoniserade i magsäcken. Basiska LM absorberas alltså enbart från tunntarmen, där lipofiliciteten och och exponering av polär yta bestämmer de relativa hastigheterna.
- slutligen bör påpekas att absorptionen även påverkas av en rad faktorer som inte är av renodlat fysikalisk-kemisk natur, bl.a.: mängd och typ av födointag, tarmmotilitetoch interaktion med andra LM.
Distribueringen
- Fördelningen av LM i olika vävnader bestäms ffa av lipofiliciteten, de polära ytegenskaperna och syra-basegenskaperna, pga. att cellmembraner måste passeras (samma faktorer som bestämmer absorbtionen från mag-tarmkanalen gäller) och kommer att spela in både vad beträffar fördelningshastigheten och de absoluta koncentrationerna i olika vävnader. Blodet tjänar som transportmedium, men för lipofila LM krävs proteinerna som blodet tillhandahåller. Det viktigaste proteinet när det gäller bindning av såväl LM som kroppsegna föreningar är albumin, som utgör ca. 60% av plasmaproteinerna. Bindningstyperna är av samma slag som LM-receptorinteraktionerna, d.v.s. elektrostatiska, van der Waals-krafter, vätebindning och hydrofob bindning. Bland LM tycks många ha oväntat sprcifika bindningsställen på albuminmolekylen med relativt höga associationskonstanter (gäller ffa lipofila, anjoniska föreningar).
- Betydelsen av hög proteinbindning av LM ligger i att denna bundna fraktion tjänar som depå, som står i jmv med den obundna, terapeutiskt verksamma fraktionen (lägre proteinbindning = uppnår terapeutisk koncentration vid betydligt lägre total blodkoncentration). Vid hög proteinbindningsgrad erhålls en relativt jämn vävnadskoncentration mellan dosintervallen, då jmv förskjuts från den bundna depån allteftersom LM elimineras ur kroppen. Om emellertid fritt LM försvinner snabbt ur blodbanan p.g.a exv. aktiv sekretion eller ovanligt snabb metabolism, hjälper inte ens hög proteinbindningsgrad för att upprätthålla blodkoncentrationen, eftersom det föreligger en snabb jmv mellan bundet och obundet LM.
Elimineringen
Elimineringen kan sägas bestå av två huvuddelar, nämligen läkemedelsmetabolism och utsöndring.
- Utsöndringen består ofta av en rad samtidiga processer, där aktiv och passiv renal utsöndring samt utsöndring till faeces via gallan är viktigast. Återigen är det fördelningsegenskaperna som syra-basegenskaperna, som bestämmer den relativa betydelsen av en viss process. (t.ex. LM som är relativt lipofila resorberas i stor utsträckning från primärurinen i tubuli till blodet via oladdad diffusion. t.sk.f. mkt hydrofila LM som ej resorberas och följer med urinen ut ur kroppen). Detta gäller under förutsättning att det saknas aktiv resorbtion genom cellväggarna i tubuli, såsom är fallet med aminosyror och glukos. Storleken på molekylen spelar en viktig roll för utsöndringen i gallan (små molekyler utsöndras knappast alls via den vägen), först när molekylvikten ligger över 300-400 börjar denna utsöndringsväg spela någon praktisk roll. Både an- och katjoner, liksom neutrala föreningar innehållande både polära och lipofila grupper, kan utsöndras i gallan (exv. penicilliner(anjon), tubokurarin(katjon), hjärtglykosider(neutral).
- Entero-hepatiska kretsloppet: om ett LM utsöndras i gallan och sedan delvis resorberas i tarmen kan ett kretslopp av utsöndring och resorbtion uppstå.
Ett LM kan också förändras (ofta deaktiveras), genom en eller flera kemiska reaktioner, innan det slutligen lämnar kroppen. Arten och omfattningen av metabolismen av en viss förening avgörs i allra högsta grad av dess fysikalisk-kemiska egenskaper (här är det ej endast fördelnings- och syra-basegenskaperna som spelar in, utan även tidigare genomgångna egenskaper som, reaktivitet, form mm.)
*För att ett LM skall kunna metaboliseras i levercellerna krävs en viss lipofilicitet för att passera cellmembranen (t.ex. mkt hydrofila aminoglykosider metaboliseras inte)
Kapitel 6, kunna redogöra för/tillämpa:
1. Begreppen kandidatsubstans ("candidate drug", CD) och ledtrådssubstans ("lead compound")
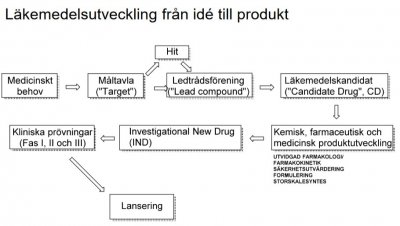
Framtagning av nya läkemedelskandidater innebär nästan alltid att man i slutskedet, strax före val av CD, gör relativt små förändringar av en grundstruktur, en ledtråd (lead compound eller oftast "lead"). Inom ett visst projekt kan det ursprungligen ha identifierats en mängd måttligt aktiva föreningar, något som är normalt i en s.k. HTS-kampanj (från eng. High Throughput Screening), där hundratusentals föreningar från ett företags substansbank testats. De slutliga ledtrådarna väljs sedan efter en rad andra preliminära tester/mätingar, avseende bl.a. selektivitet, metbolism, genotoxicitet och fysikalisk-kemiska egenskaper.
2. Lipinskis regler

Gäller för alla stadier, från ledtråd till CD. "Tekniskt utvecklingsbar till LM"/"Druggable"
De generella kraven på en ledtråd kan sammanfattas i följande punkter:
- Attraktiva fysikalisk-kemiska egenskaper som ökar sannolikheten att en förening som kommer ur serien, duger sett ur DMPK- och farmaciaspekter ("druggability"). Några enkla tumregler lanserades i slutet på 1900-talet av C.A. Lipinski som "Lipinski´s rule of fives". Dessa gäller för alla stadier från ledtråd till CD.
- M<500D
- Vätebindningsdonatorer <5
- Vätebindningsacceptorer <5
- 5 < Log P > -1
- Förväntade möjligheter att framställa patentbara föreningar
- Möjlighet att enkelt och billigt syntetisera många, rikt varierade strukturer
- Frånvaro av potentiellt genotoxiska strukturelement (om de verkar svåra att bygga bort)
- Skall gärna vara liten, då modifieringsprocessen tenderar att bygga på molekylen snarare än att ta bort något
Avsikten med de modifierade strukturerna är framställningen av föreningar med i något avseende annorlunda och bättre egenskaper ifråga om t.ex. aktivitet/potens, sekeltivitet, toxicitet eller farmakokinetiska egenskaper (absorbtion, metabolism eller duration).. fördelaktligen "me too" eller ännu hellre "me better" prepparat". Observera att avvikelser finns som i många antibiotikastrukturer.
3. Begreppet farmakofor
Den förening innehållande det minimala strukturelement som ger i det närmaste lika hög aktivitet som den komplicerade ursprungsföreningen.
- en farmakofor skall inte uppfattas såsom utgörande en reell molekyl, utan mera som en kemisk beskrivning av de sammantagna delar som kännetecknar aktivitet vid ett visst biologiskt verkningsställe (receptor). Begreppet är mer att uppfatta som en arbetsmodell/-hypotes baserad på rådande kunskap och kallas även för farmakoformodell. En farmakofor kan även beskrivas matematiskt, och därför kan man med hjälp av dator söka i strukturdatabaser efter molekyler som liknar farmakoforen. En receptormodell talar man om när utgångspunkten är bindningsstället på protinet, där egenskaperna i vissa områden beskrivs, exv. hydrofob ficka, vätebindningsdonator etc. Det är farmakoforen som komplementärt beskriver receptormodellen.
4. Begreppen isosteri/bioisosteri
Isosteri: en av de enklaste men ändå viktigare begreppen vid framställning av analoger och som i korthet innebär att man ersätter en atom eller en grupp av atomer i den ursprungliga föreningen med en grupp som har sådana egenskaper att den nya föreningen får i stort sett samma slag av biologisk aktivitet men oftast andra DMPK-egenskaper ( och kanske även ändrad löslighet). Ur kemisk synvinkel kan grupperna vara rätt olika och man talar därför hellre om bioisosteri i detta sammanhang.
- Isosteri används som ett grovt men bekvämt sätt att klassificera kemiska gruppers likheter/olikheter i att förmedla intermolkylära krafter. (isosterer har samma valens)
Bioisosteri: läran om bioisosteri utgörs av en samling empiriska regler som rutinmässigt tillämpas i läkemedelskemin vid synteser av nya analoger.
- Bioisosteri kan möjliggöra utveckling av nya läkemedel eller andra biologiskt intressanta föreningar. En detaljerad farmakologisk analys som man gjort med bioisostert utbyte skulle ganska säkert påvisa ändrade egenskaper vid flera receptorer (annan receptorprofil), jämte annorlunda metabolism/farmakokinetik. (Detta utgör dock ej allvarligare kritik mot isosteribegreppet utan man måste ta fasta på orden "i stort sett samma biologisk aktivitet"). Beroende på vilken av en grundstrukturs egenskaper som man vill påverka, kan en bioisoster grupp av lämplig beskaffenhet väljas. (Exempelvis kan följande parametrar beaktas: storlek och form, elektroniska egenskaper (polariserbarhet, polaritet, induktiva effekter, laddning), lipofilitet/hydrofilitet, pKa, kemisk reaktivitet (inkl. känslighet och metabolism) och vätebindningsförmåga). (Bioisosterer, icke-klassiska isosterer: Har liknande fysikalisk-kemiska egenskaper och ger samma biologiska effekt.)
Kapitel 7, kunna redogöra för/tillämpa:
1. De grundläggande resonemang som tillämpas i samband med studier av kvantitativa struktur-effektsamband (Quantitative Structure-Activity Relationships, QSAR)
Kvantitativa struktur-effektsamband: syftet är att forma en matematisk modell för struktur-effektsamband inom en avgränsad substansfamilj.
Växelverkan läkemedel-receptor: En läkemedelsmolekyl (Lm) växelverkar med sin receptor (Rc) genom kemiska bindningar av olika slag, t.ex. vätebindning, jonbindning, dipol-dipolbindning, dispersionskrafter och -i några få fall -kovalent bindning. Bindningen läkemedel-receptor resulterar i en biologisk effekt, Eb.
Det finns ofta ett tydligt samband mellan biologisk effekt och fri energi i läkemedel-receptorinteraktionen. Linear Free-Energy Relationship, LFER
En allmän QSAR-ekvation innehållande några vanliga deskriptorer:![]()
QSAR-ekvationen bygger på statistisk analys av biologiska mätdata.
Kvantitativa struktur-effektsamband
Interaktionen mellan läkemedelsmolekyl och receptor kan behandlas matematiskt efter i huvudsak samma principer som gäller för andra kemiska reaktioner. Den kanske mest kände pionjären på området kvantitativa struktur-effektsamband är Corwin Hansch, som har fått ge namn åt den s.k. Hansch-ekvationen:
![]()
Termen log(1/C) kan också skrivas -logC eller pC.
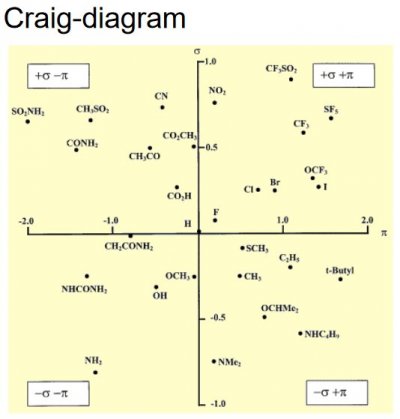
2. Vilka huvudtyper av fysikalisk-kemiska despriptorer som används i QSAR-studier.
Hydrofobicitetsdeskriptorer (logP, π, Fr)
- Hydrofobicitetsdeskriptorer kallas också lipofilicitetsdeskriptorer. Lipofiliciteten har ofta ett starkt inflytande på den biologiska effekten:
- Passage genom olika slags lipidhaltiga membran på vägen till målprotein.
- Från polär omgivning till mindre polär bindningsficka under inbindningsprocessen.
- Löslighet
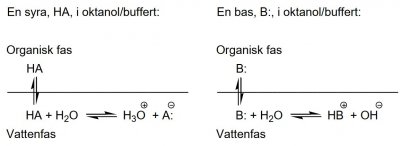
Log P och andra lipofilicitetsdeskriptorer beskriver ett ämnes fördelningsegenskaper i ett lösningsmedelssystem bestående av en organisk fas och en vattenfas.
För en icke-protolyt Z gäller:
Log P (lösningsmedelssystem:1-oktanol/vatten) logP=log([Z]org/[Z]aq)
Vad gäller protolyter är förhållandena mer komplicerade. I litteraturen angivna log P-värden kan vara bestämda vid pH = 7,4 i vattenfasen (buffrad), och är då i själva verket log D-värden.

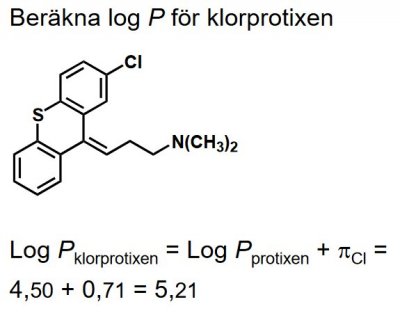
Andra hydrofobicitetsdeskriptorer; beräkning av log P. Vid beräkning av log P är det säkrast att utgå från en referenssubstans/grundstruktur med känt log P och lägga till hydrofobicitetsbidrag från substituenter. Deskriptorn π uttrycker hydrofobicitetsbidraget från substituenter i aromatiska molekyler. π-Värdet för en väteatom är satt till noll, d.v.s. π(H)= 0. Log P för klorobensen (Ph-Cl) minus log P för bensen (Ph-H) ger klorgruppens π-värde:
Kännetecknande för π-värden och andra deskriptorer är att de vanligtvis är additiva. Med kännedom om log P för bensen och π(Cl) kan man beräkna log P för t.ex. 1,3-dikloro-bensen: log P(1,3-diklorobensen) = log P(Ph-H)+ 2π(Cl)= 2,13 + 2×0,71= 3,55
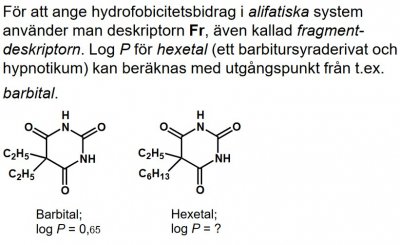
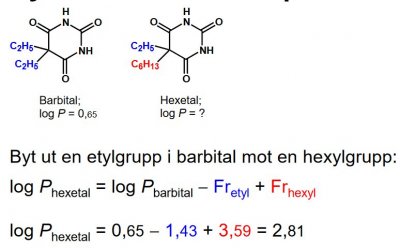
Elektroniska deskriptorer (σ, F, R, pKa)
Hammetts σ-värde, som uttrycker en substituents elektrondonerande/elektronattraherande effekt, är baserat på protolysjämvikter för ringsubstituerade bensoesyror:
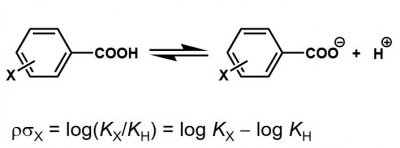
Faktorn ρ kallas reaktionskonstant och ρ=1 för ovannämnda protolysjämvikter. σ-Värdet för en väteatom är satt till 0, d.v.s. σ(H)= 0.
σ(X) beräknas enklast på detta sätt: σ(X)=pKa(bensoesyra)-pKa(X-bensoesyra)
Beräkningsexempel:
σ(para) för CH(3)
σ(p-metyl)= pKa(bensoesyra)-pKa(p-metyl-bensoesyra) = 4,19-4,36= -0,17
Beräkna pKa för p-nitrobensoesyra:
σ(p-nitro)= pKa(bensoesyra) - pKa(p-nitro-bensoesyra)
0,78= 4,19 - pKa(p-nitrobensoesyra)
pKa(p-nitrobensoesyra) = 4,19-0,78= 3,41
σ < 0 elektrondonerande grupp
σ > 0 elektrondragande grupp
Hammetts σ-värden innehåller både en induktiv och en mesomer komponent. Resonansinslaget är starkare i σ(p) än i σ(m).
Jämför:
σ(p-metoxi)= - 0,27
σ(m-metoxi)= 0,12
p-Metoxi är konjugerad med karboxylgruppen t.sk.f. ingen konjugation mellan m-metoxi och karboxyl-gruppen.
Swain-Luptons positionsoberoende elektroniska deskriptorer F(fälteffekt) och R(resonanseffekt, mesomer effekt) bygger på Hammet-deskriptorer faktoriserade i induktiv och mesomer effekt ![]()
Steriska deskriptorer (Es, Vm, Mw, MR)
Reaktionshastigheten vid sur esterhydrolys påverkas obetydligt av elektroniska effekter, men starkt av steriska. Tafts steriska deskriptor, Es, baseras på kinetikdata från sur esterhydrolys och definieras:Es=log(k/ko); k är hastighetskonstanten för den steriskt mer hindrade estern; k < ko
En stor substituent har ett algebraiskt lägre Es-värde än en liten grupp.
En annan sterisk deskriptor är molär refraktivitet, MR, som definieras:
Kapitel 8, kunna redogöra för/tillämpa:
1. Begreppen fas I- och fas II-reaktioner samt ge exempel på sådana
De läkemedelsmetaboliska reaktionerna som generellt syftar till att mer hydrofila, lättutsöndrade ämnen skall bildas, delas traditionellt in i fas I- och fas II- reaktioner.
Fas I -reaktioner: funktionalitetsreaktioner, t.ex. oxidation
Ny funktionell grupp introduceras i molekylen t.ex. oxidation av ett kolväte till en alkohol. (läkemedel undergår oftast ett antal på varandra följande fas I -oxidationer)
Fas II -reaktioner: konjugeringsreaktioner, t.ex. glukuronsyrekoppling
Fas I metaboliten kopplas till en kroppsegen substans, vanligtvis via en kondensationsreaktion. Om läkemedlet från början innehåller en lämplig funtionell grupp kan det undergå fas II- metabolism direkt, d.v.s utan förgående fas I -metabolism.
|
Fas I-reaktioner |
Fas II-reaktioner |
|
|
2. Begreppet förstapassagemetabolism
För att ett systemiskt verkande, oralt intaget, läkemedel skall ha effekt krävs en bra absorbtion från mag-tarmkanalen av läkemedlet, men också att adekvata koncentrationer når målorganet. Efter absorbtion i mag-tarmkanalen transporteras läkemedlet vidare till levern via blodflödet i portådern. Metabolismen av läkemedlet sker oftast huvudsakligen i levern, men kan börja redan under absorbtionsfasen i tarmen. Efter sin passage från tarmen och genom levern kommer blodet ut i den systemiska cirkulationen. Den koncentration av det givna läkemedelt som detta blod innehåller kommer att är beroende av hur mycket som undergått metabolism i tarmväggen och under den första passagen genom levern. Denna metabolism definieras som förstapassagemetabolismen (first pass metabolism). Läkemedel med hög förstapassagemetabolism uppvisar dålig effekt efter oralt intag. Ett exempel på ett sådant läkemedel är morfin.
Kapitlen 10-42 (9-49), kunna redogöra för/tillämpa:
1. Generella strukturformler för läkemedel som vi har i Sverige och förståelse för deras struktur-effekt samband.
*för att få en mer konkret bild av molekylstrukturen hos olika slags läkemedelsgrupper bör du lära in strukturformlerna för ett urval av referensföreningarna (inkl. endogena transmittorsubstanser och generella strukturklasser i kursiverad stil) enl. nedanstående förteckning.
Kapitel 9 (3:e)/ Kapitel 10 (4:e)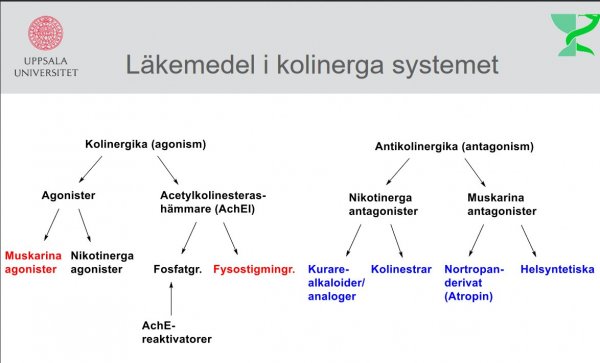
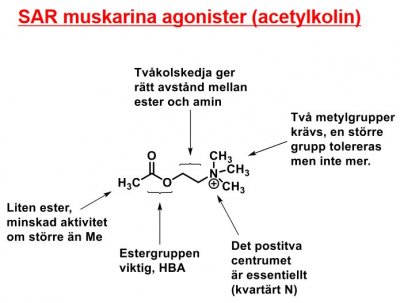
| Acetylkolin | 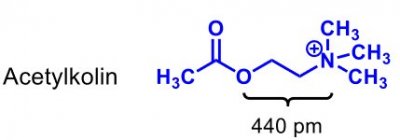 |
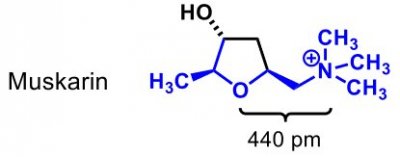
| Muskarin |
|
| Nikotin |
|
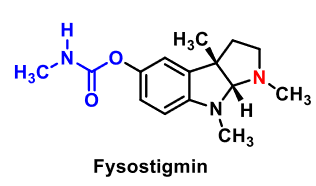
| Fysiostigmin |
|
| Neostigmin |
|
Kapitel 10 (3:e)/ Kapitel 12 (4:e)
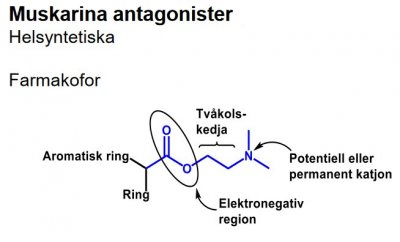
| Atropin | 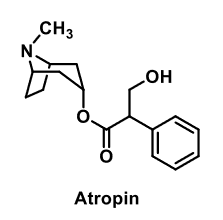 |
| Cyklopentolat | 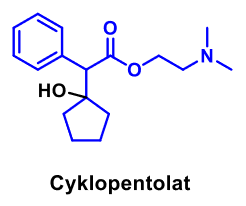 |
Kapitel 11 (3:e)/ Kapitel 13 (4:e)
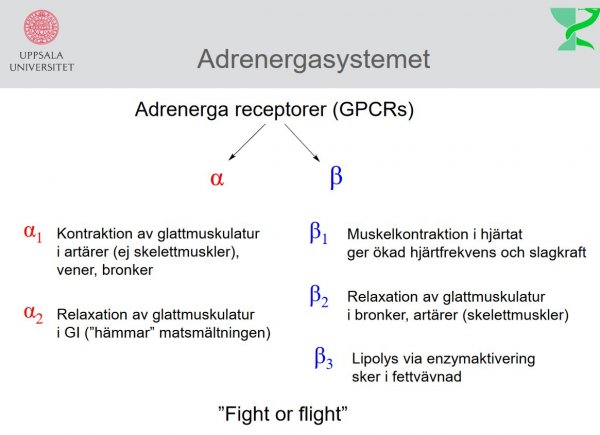
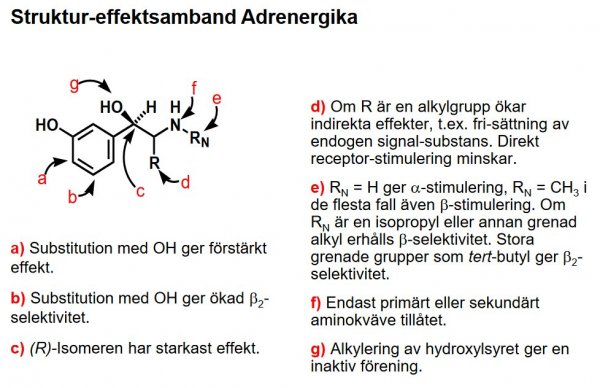
| Adrenalin (epinefrin) | 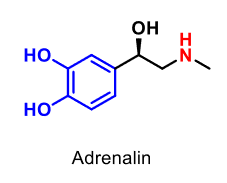 |
| Noradrenalin (norepinefrin) | 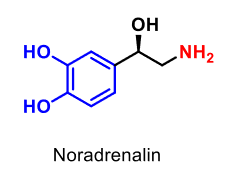 |
| Isoprenalin | 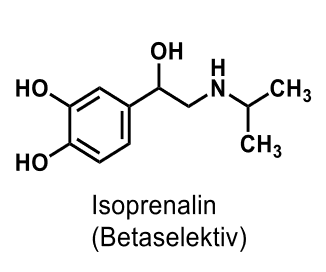 |
|
Terbutalin |
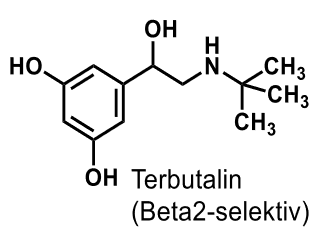 |
Kapitel 12 (3:e)/ Kapitel 14 (4:e)
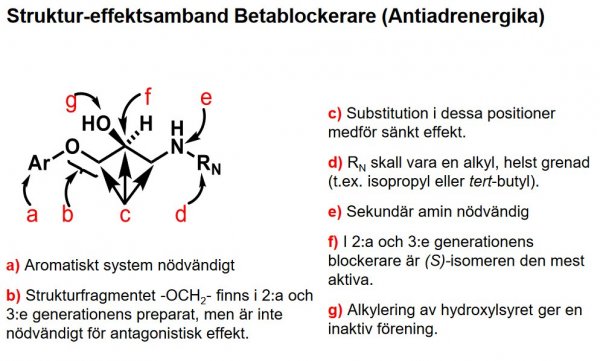
| Propranolol | 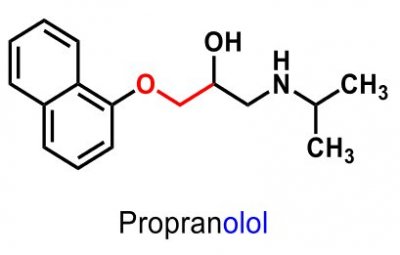 |
Betablockerare 2:a generationen, oselektiva |
| Atenolol | 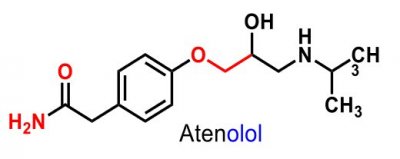 |
3:e generationen, β1- selektiva |
Kapitel 13 (3:e)/ Kapitel 15 (4:e)
Triptaner (medel mot migrän)
| Serotonin | 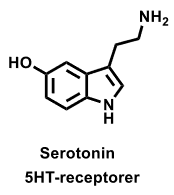 |
| Sumatriptan | 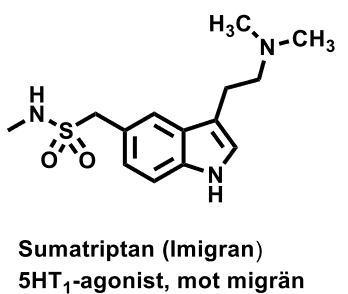 |
Kapitel 14 (3:e)/ Kapitel 16 (4:e)
Muskelrelaxerande medel med centralnervös verkan (svårklassificierad)
Kapitel 15 (3:e)/ Kapitel 16 (4:e)
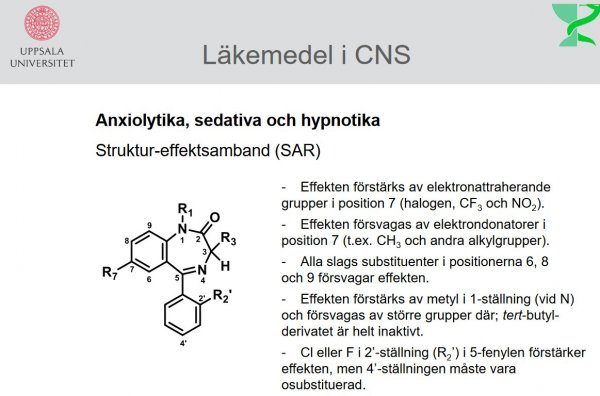
| Diazepam | 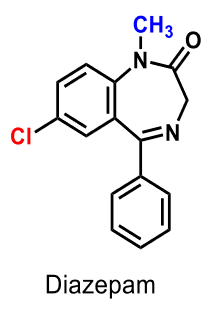 |
Anxiolytika, sedativa och hypnotika: Bensodiazepiner
|
Kapitel 16 (3:e)/ Kapitel 17 (4:e)
|
Fenytoin |
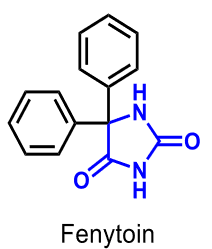 |
| Karbamazepin | 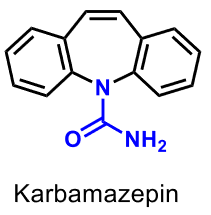 |
| Valproinsyra |  |
Kapitel 17 (3:e)/ Kapitel 18 (4:e)
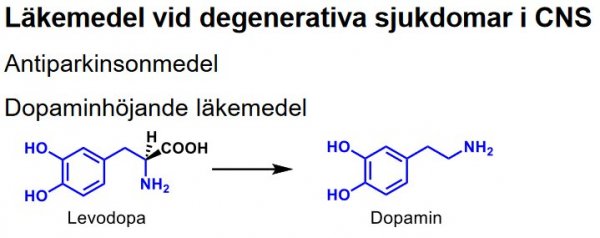
| Dopamin | 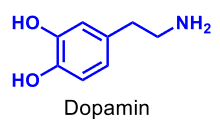 |
Antiparkinsonmedel Obrukbar mot Parkinsons sjukdom pga, kan ej passera BBB. anv. dock i intravenös infusion vid chocktillstånd ism hjärtinfarkt och hjärtkirurgi. |
| Levodopa | 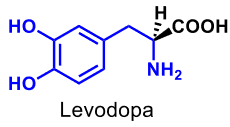 |
Antiparkinsonmedel Prekursor till dopamin [L-(-)-dopa], kan via aktiv transport föras in i CNS och genom dekarboxylering omv. till dopamin. |
| Selegilin | 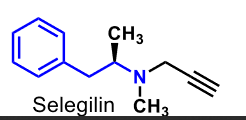 |
Selektiv MAO B-hämmare |
| Rivastigmin |  |
Medel vid Alzheimers sjukdom Strukturellt förenklad, helsyntetisk analog till fysiostigmin. AChE inaktiveras temporärt genom att serinhydroxylen i enzymets aktiva centrum karbamoyleras. |
Kapitel 18 (3:e)/ Kapitel 20 (4:e)
| Amfetamin | 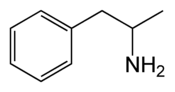 |
Passerar BBB och anses verka genom att frisätta dopamin och noradrenalin i hjärnan. Viss terapeutisk anv. vid t.ex. narkolepsi och ADHD (Attention Defict Hyperactivity Disorder) |
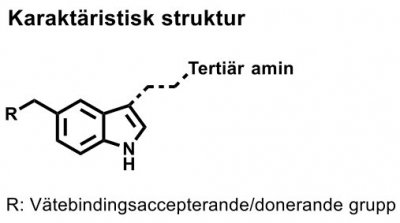
| Amitriptylin | 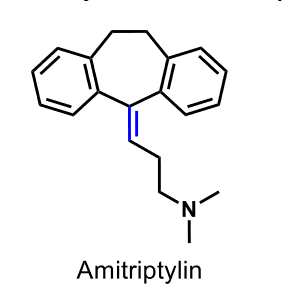 |
Psykofarmaka Antidepressiva: Tricykliska antidepressiva (TCA) Karakteristisk struktur: treringssystem med sjuledad mittring. En dubbelbunden trekolskedja förbinder den sjuledade ringen med en tertiär eller en sekundär aminogrupp. |
| Imipramin | 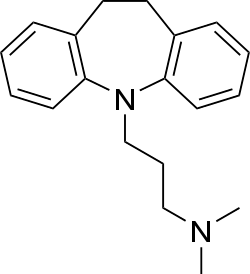 |
Kvävehaltigt ringsystem/ Tricykliskt ringsystem |
| Fluoxetin | 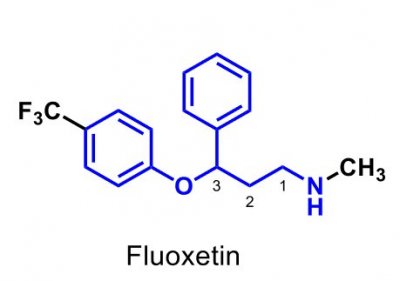 |
Psykofarmaka Antidepressiva Selektiva hämmare av serotoninåterupptag (SSRI) Karakteristisk struktur: en 3-aryloxipropanaminsubstituerad med en arylgrupp i 3-eller 1-position. |
| Klorpromazin | 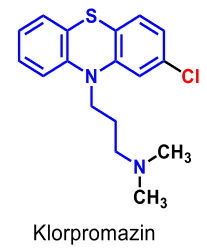 |
Psykofarmaka, Neuroleptika, Fentiazinderivat - trekolskedja, substitution m. en elektrondragande (elektronegativ) grupp i 2-ställning i fentazinringen höjer vanl. effekten, medan införandet av substituenter i 3- eller 4-ställning oftast sänker densamma. |
| Klorprotixen | 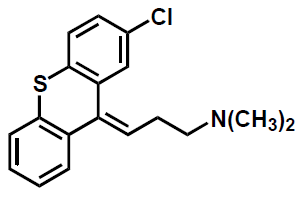 |
Psykofarmaka, Tioxantenderivat - sidokedjor m aminogrupper, jmf. m. tricykliska antidepressiva (t.ex. amitryptilin) och fentiazinneuroleptika (t.ex. flufentazin) - pga. ringsystem med dubbelbunden sidokedja och substituent i ringatom nr 2, finns förutsättningar för (E,Z)-isomeri hos tioxantenerna. |
| Haloperidol | 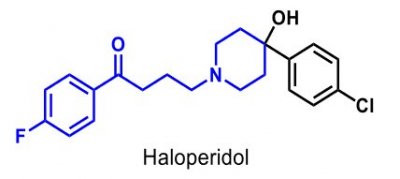 |
Psykofarmaka, Neuroleptika, Fenylbutanonderivat, |
Kapitel 19 (3:e)/ Kapitel 20 (4:e)
| Morfin | 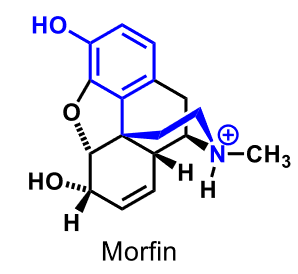 |
Opioidfarmakoforen: en aromatisk ring, bunden till en kolatom eller en icke-basisk kväveatom. Varken kolatomen eller kväveatomen får binda väte. Kolatomen skall via en tvåkolskedja vara bunden till ett tertiärt aminokväve. Den icke-basiska kväveatomen skall via en trekolskedja vara bunden till en tertiär aminogrupp. |
| Petidin | 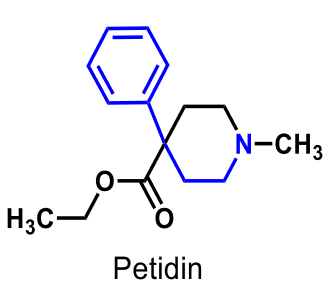 |
Fenylpiperidinderivat |
| Metadon | 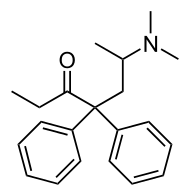 |
Difenylpropylaminderivat, Strukturvillkor: kedjan mellan aromatisk grupp och aminokväve skall bestå av tre kolatomer. Ytterligare en alifatisk grupp skall ingå. Denna innehåller för det mesta en karbonylgrupp. Den kolatom som binder dimetylaminogruppen i metadon är asymmetrisk, och kan sägas motsvara C9 i morfin där det råder (R)-konfiguration. (R)-Metadon har en analgetisk effekt av samma storleksordning som morfin, medan (S)-formen är närmast inaktiv. Metadon absorberas, t.sk.f. morfin, väl från mag-tarmkanalen och kan därför användas i perorala beredningar. |
| Fentanyl | 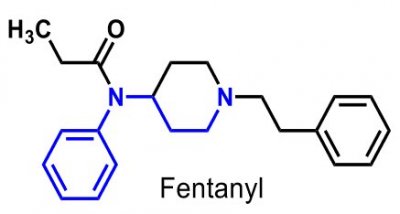 |
Basiska anilider, Acylerad och icke-basisk kväveatom, samt en aminogrupp (utg. det basiska strukturelementet) - anv. ffa som analgetika vid kirurgiska eller diagnostiska ingrepp och för postoperativ smärtlindring (sufentanil). - finns som: injektabilium, depåplåster och sugtablett. |
Kapitel 20 (3:e)/ Kapitel 21 (4:e)
| Isofluran | 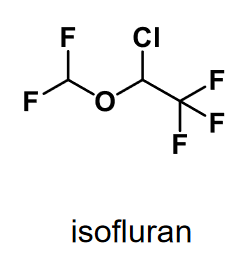 |
Allmänanestetika, - dämpande effekt genom blockad av neuronala jonkanaler. (effekt- beroende av enkla fysikalkemiska egenskaper t.ex. fördelningskoefficienten lipid/vatten. Inhalationsanestetika, Alkylhalider/halogenerade etrar Isofuran uppvisar viss stereoselektivitet gentemot betydelsefulla jonkanaler. |
Kapitel 21 (3:e)/ Kapitel 11 (4:e)
| Suxameton | 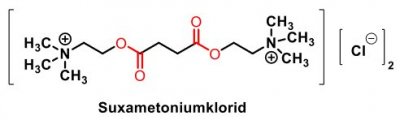 |
Muskelrelaxerande medel med perifer verkan Kolinestrar, - tio bindningsled mellan kvävena - verkar depolariserande i nervändplattan och ger därför initialt en kortvarig acetylkolinlik effekt. Dess muskelförlamande effekt kan inte hävas mha acetylkolinesterashämmare. Nikotinerga antagonister, Kurare alkaloider/analoger, ger neuromuskulär blockad med muskelavslappning eller förlamning som följd. Används vid kirurgiska ingrepp. Depolariserande |
Kapitel 22 (3:e)/ Kapitel 21 (4:e)
| Kokain |  |
Alkaloid, Derivat av aminohydroxisyran ekgonin, som är strukturellt besläktad med tropin. Karboxylgruppen, förestrad m metanol och alkoholgruppen m bensoesyra. Principiell uppbyggnad: aromat struktur- mellankedja- aminogrupp |
| Lidokain | 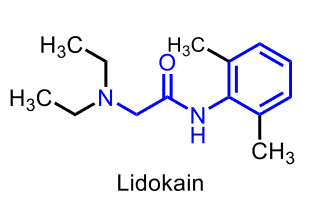 |
Alkaloid, Amider |
Kapitel 23 (3:e)/ Kapitel 22 (4:e)
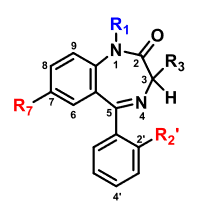
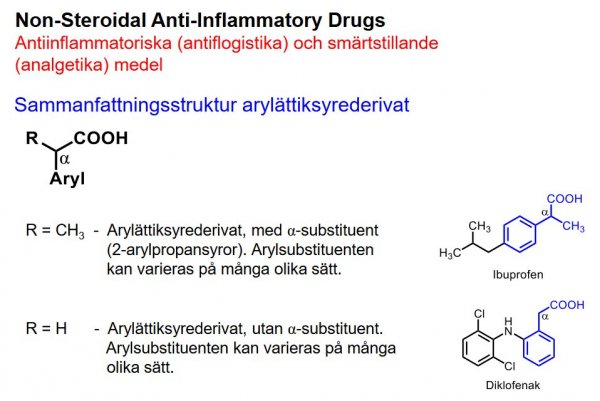
Non-Steroidal Anti-Inflammatory Drugs.
Antiinflammatoriska (antiflogistika) och smärtstillande (analgetika) medel
| Acetylsalicylsyra | 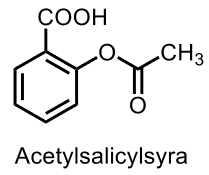 |
- salicylsyra derivat |
| Ibuprofen | 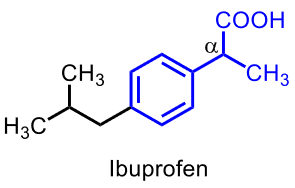 |
- Arylättiksyrederivat, med α-substituent (2-arylpropansyror)
|
| Celecoxib | 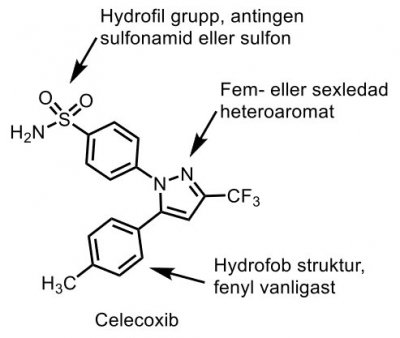 |
- Coxiber, selektiva hämmare av COX-2 |
| Paracetamol | 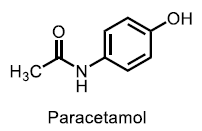 |
- Lätta analgetika, Anilider Analgetisk och antipyretisk effekt, men saknar antiinflammatorisk effekt. |
Kapitel 24 (3:e)/ Kapitel 22 (4:e)
| Cimetidin | 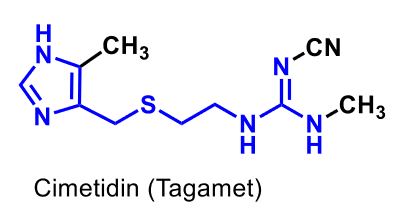 |
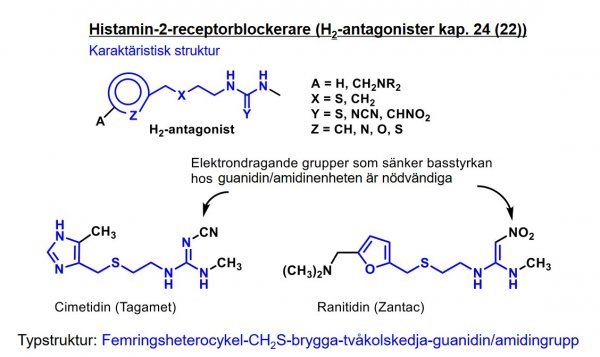 |
| Omeprazol | 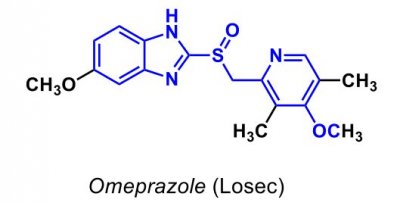 |
- Protonpumpshämmare |
| Sulfasalazin | 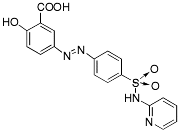 |
"övriga medel mot magsår" - medel mot inflammatoriska tarmsjukdomar |
Kapitel 25 (3:e)/ Kapitel 23 (4:e)
| Glibenklamid | 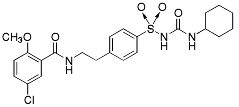 |
Antidiabetika Medel vid typ 2-diabetes -Sulfonureider |
Kapitel 26 (3:e)/ Kapitel 43 (4:e)
Vitaminer och vitaminanaloger
- allmänt kan sägas att även en högst begränsad strukturmodifikation i en vitaminmolekyl oftast medför att vitamineffekten drastiskt minskar. Syntetiska analoger till de naturliga vitaminerna har därför som regel inte visat sig vara användbara substitut, men har i vissa fall (t.ex. acitretin och kalcipotriol) visat sig ha ett annat värde. Vitaminerna indelas traditionellt in i fettlösliga och vattenlösliga, men en indelning efter kemiska grunder blir knappast meningsfull, eftersom så många strukturtyper är företrädda.
Kapitel 27 (3:e)/ Kapitel 24 (4:e)
Läkemedel som påverkar blodkoagulationen
| Warfarin |  |
Kumarinderivat - antagoniserar vitamin K genom att hämma enzymet vitamin K-epoxidreduktas. Vitamin K är nödvändigt för biosyntesen av protrombin, ett förstadium till enzymet trombin. Detta omvandlar vattenlösligt fibrinogen till den olösliga polymeren fibrin, varvid koagulation inträder. |
| Klopidogrel | 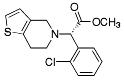 |
Trombocytaggregationshämmare - bicykliskt ringsystem 4,5,6,7-tetrahydrotienol[3,2-c]pyridin. - Ringsystemets kväveatom är substituerad m. en o-klorobensylgrupp. I klopidogrel är bensylatomen dessutom bunden till en metoxikarbonylgrupp. Härigenom blir molekylen kiral. Endast (S)-isomeren används terapeutiskt. Båda substanserna bildar aktiva metaboliter som binds irreversibelt till trombocyternas ADP-receptorer (ADP=adenosindifosfat) och därigenom hämmar trombocytaggregationen. |
| Tranexamsyra | 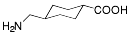 |
Antifibrinolytika -LM som motverkar blödning genom att hämma bildningen av det fibrinupplösande enzymet plasmin. Detta är den enda representanten för denna LM grupp i Sverige. |
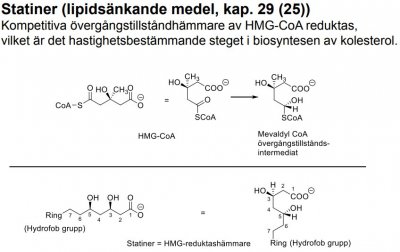
Kapitel 29 (3:e)/ Kapitel 25 (4:e)
| Atorvastatin | 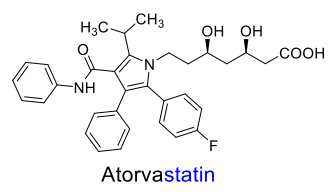 |
- statinerna är specifika hämmare av leverenzymet 3-hydroxi-3metylglutaryl-coenzym A-reduktas (HMG-CoA-reduktas), som katalyserar omv. av HMG-CoA till mevalonsyra (ett tidigt reaktionssteg i kolesterolbiosyntesen). - p-substituerad fenylgrupp och pyrrol resp. pyrimidin utg. heteroaromatiska komponenten. Innehåller enbart stereoisomeren (3R,5R). |
Kapitel 30 (3:e)/ Kapitel 26 (4:e)
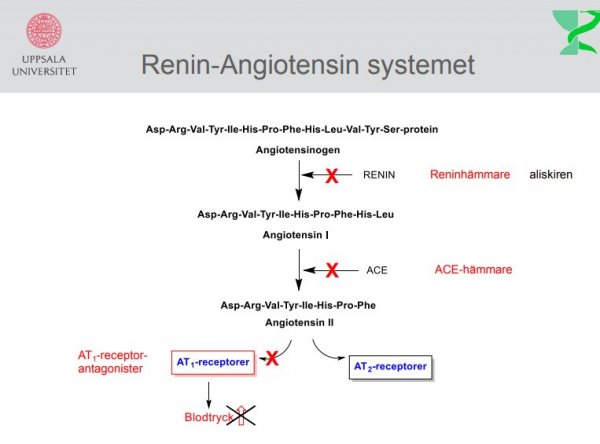
Antihypertensiva och kärlvidgande medel: (medel mot högt blodtryck) och kärlvidgande medel som ej verkar via adrenerga eller kolinerga mekanismer.
| Peptid och aminosyrorna | ||
| Glycerylnitrat | Alkylnitrater | |
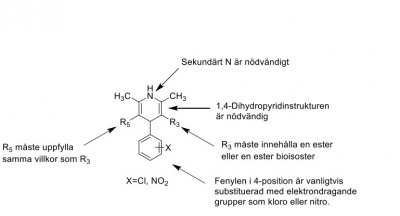
| Nifedipin | 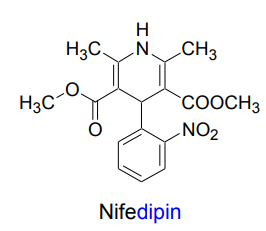 |
Kalciumantagonister 1,4-Dihydropyridiner (dipiner)
|
| Kaptopril | 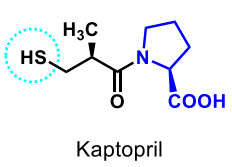 |
Medel som påverkar renin-angiotensin-systemet ACE-hämmare
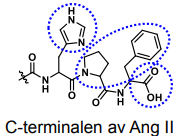
-antihypertensivum, hämmar enzymet ACE (Angiotensin-Converting-Enzyme, angiotensinkonvertas), som omvandlar angiotensin I till angiotensin II. Denna enzymhämning leder i sin tur till minskad aldosteronfrisättning och sänkt blodtryck. |
| Losartan | 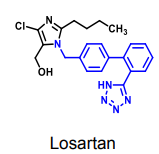 |
Angiotensin II antagonister
|
Kapitel 31 (3:e)/ Kapitel 27 (4:e)
Antiarrytmika och hjärtstimulerande medel
| Flekainid | 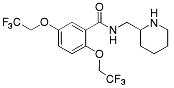 |
Antiarytmika -tillhör klass IC och kan kemiskt klassificeras som ett derivat av bensamid. - står strukturmässigt nära lokalanestetiska, vilket avspeglar dess påtagliga anestetiska verkan. |
Kapitel 32 (3:e)/ Kapitel 28 (4:e)
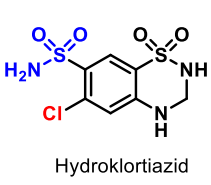
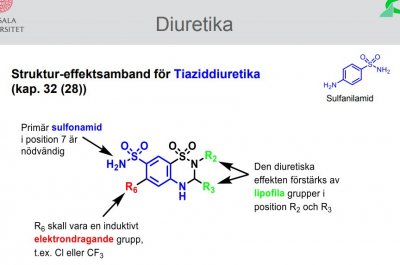
Diuretika
| Hydroklorotiazid |
|
Sulfonamiddiuretika Tiazider
|
Kapitel 33 (3:e)/ Kapitel 29 (4:e)
Sköldkörtelhormoner (levotyroxin och liotyronin) och Tyreostatika (propyltiouracil och tiamazol)
Kapitel 34 (3:e)/ Kapitel 30 (4:e)
Könshormoner och urologiska medel
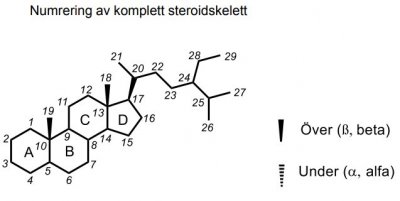
| Testosteron | 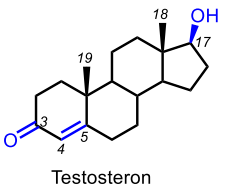 |
Könshormoner Karakteristisk stamstruktur: Androstan |
| Estradiol | 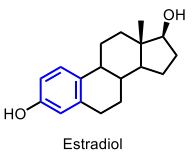 |
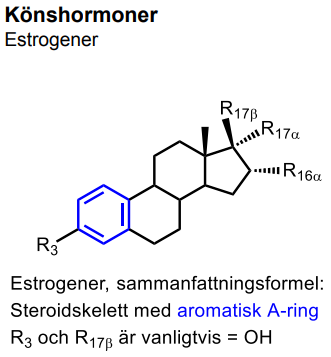 |
| Etinylestradiol | 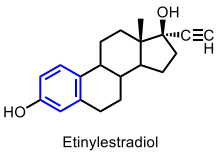 |
Estrogener |
| Progesteron | 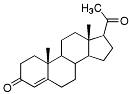 |
Gestagener (gulkroppshormonet) - i motsats till estrogenerna saknar gestagenerna aromatisk A-ring, men kolatom nr 5 är alltid dubbelbunden. Vidare kan nämnas att ketogrupp i 3-ställning brukar finnas. -naturligt hormon, anv. topikalt i form av vaginagel. |
|
Sildenafil |
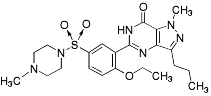 |
Urologiska medel Medel vid erektil dysfunktion |
Kapitel 36 (3:e)/ Kapitel 31 (4:e)
Kortikosteroider
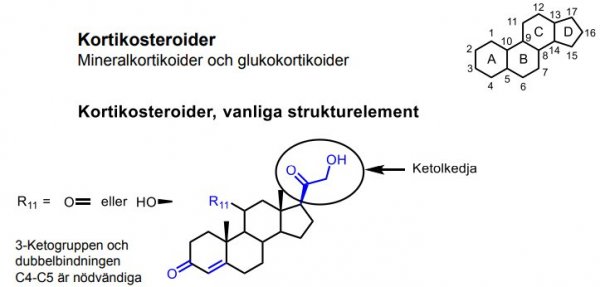
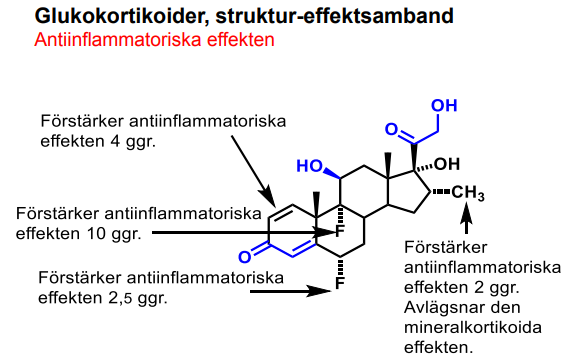
| Hydrokortison | 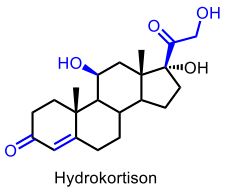 |
Glukokortikoider (antiinflammatoriska steroider) |
| Hydrokortisonnatriumsuccinat |  |
|
| Predisolon |  |
|
| Triamcinolonacetonid |  |
Acetonid (acetonacetal) |
Kapitel 37 (3:e)/ Kapitel 32 (4:e)
Antiallergiska medel
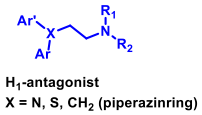
| Histamin | 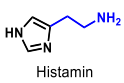 |
-frisätts ur mastceller och andra depåer - ger upphov till allergiska symtom såsom hösnuva, nässelfeber, kläda, ödem m.m (antihistaminer=H1 antagonister ) |
| Difenhydramin | 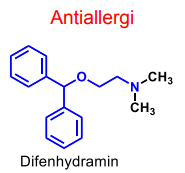 |
H1-antagonist Dimetylaminoetylderivat - eter m benshydrol (difenylmetanol) som alkoholkomponenten. -anv. mot rörelsesjuka och andra former av illamående |
| Desloratadin | 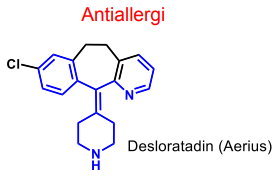 |
H1-antagonist Piperidinderivat |
Kapitel 38 (3:e)/ Kapitel 33 (4:e)
Medel mot sjukdomar i andningsvägarna
| Salbutamol | 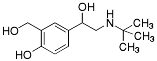 |
Antiastmatika och medel mot kroniskt obstruktiv lungsjukdom Adrenerga β2-agonister |
| Budesonid | 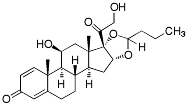 |
Glukokortikoider Mjuka glukokortikoider (inaktiveras via höggradig första-passage-metabolism, ett sätt att undvika systemiska bieffekter) |
| Oximetazolin | 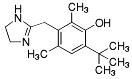 |
Medel mot rinit 2-derivat av imidazolin α1-adrenerg agonist -en av dubbelbindningarna i kväveheterocykeln i imidazol har mättats och den kvarvarande dubbelbindningen sammanlänkar kolatom nummer 2 och kvävet i 3-position. -strukturellt: en utpräglat lipofil aromat är bunden till 2-positionen i en imidazolring via en metylengrupp. -anv. som slemhinneavsvällande medel pga vasokonstriktoriska effekt. |
Kapitel 39 (3:e)/ Kapitel 35 (4:e)
Kemoterapi
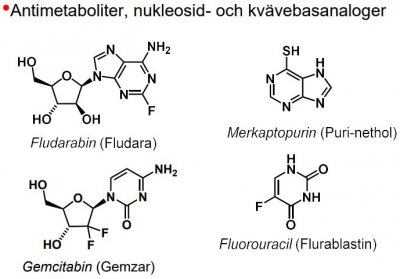
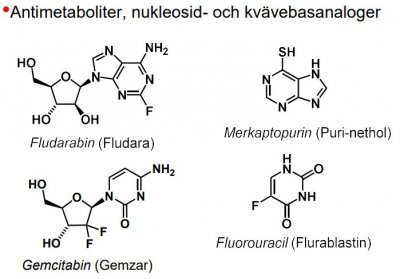
| antimetabolit |
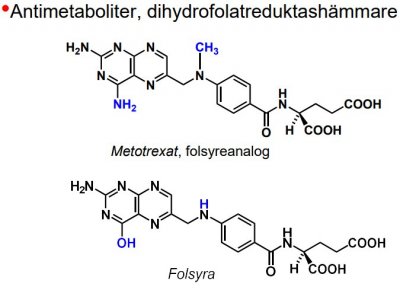
-föreningar som liknar essentiella metaboliter, men som inte kan fullgöra deras funktion, utan tvärtom förhindrar metaboliternas normala användning. -t.ex. Sulfanilamid (typisk antimetabolit), liknar 4-aminobensoesyra och påverkar dess reaktion med dihydropterindifosfat i bildningen av dihydropteroat, dvs. kompetitiv hämmare. -finns även antimetaboliter av nukleosidtyp (anv. inom cancerområdet) -Funktion: enzymhämmare och falsk byggsten.
|
Kapitel 40 (3:e)/ Kapitel 36 (4:e)
Antiparasitära medel
- insekticider samt medel mot protozoer och mask (antihelmintika)
Kapitel 41 (3:e)/ Kapitel 37 (4:e)
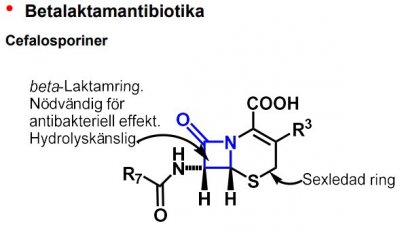
Antibakteriella medel
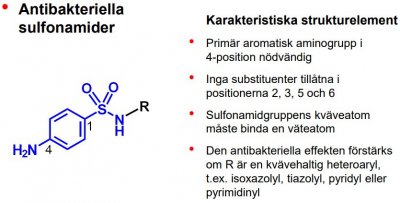
| Sulfametoxazol | 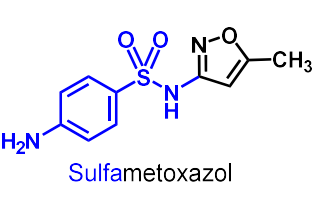 |
Antibakteriella sulfonamider
|
| Norfloxacin | 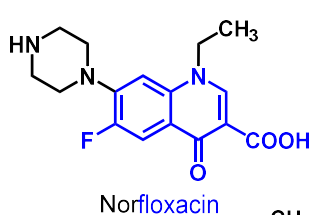 |
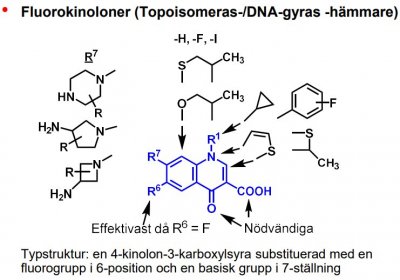 |
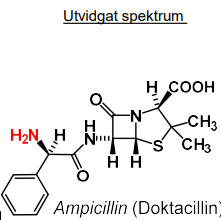
| Benzylpenicillin | 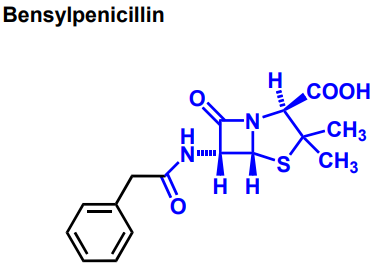 |
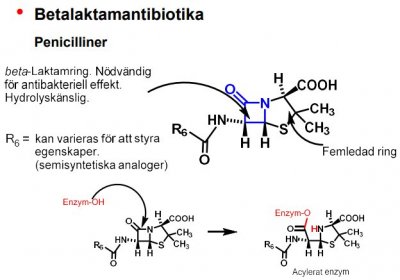 |
| Fenoximetylpenicillin | 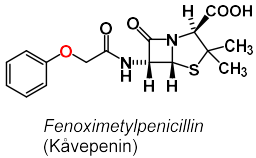 |
Betalaktamkänsligt penicillin |
| Pivampicillin | 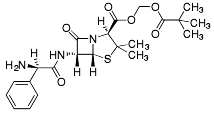 |
-prodrug av ampicillin
|
| Cefadroxil | 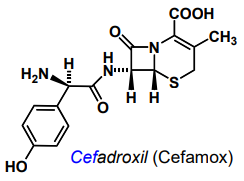 |
 |
Kapitel 42 (3:e)/ Kapitel 38 (4:e)
Medel mot mykobakterier (mellanställning i övergången mellan bakterier och svampar): antituberkulos LM
Kapitel 44 (3:e)/ Kapitel 40 (4:e)
Antivirala medel
| Nukleosid/nukleotid | 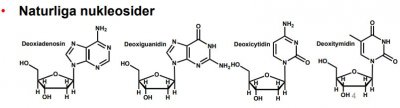 |
Typstruktur: naturlig eller modifierad kvävebas glykosidiskt bunden till naturligt eller modifierat socker |
| Proteashämmare | 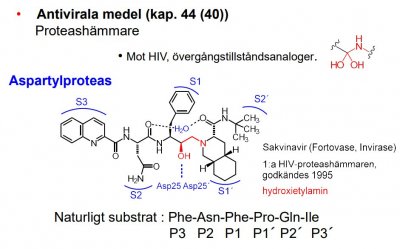 |
|
| Aciklovir | 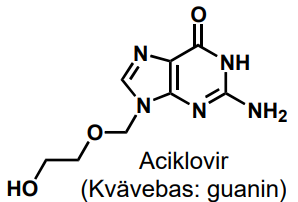 |
Antivirala nukleosidanaloger |
| Zidovudin | 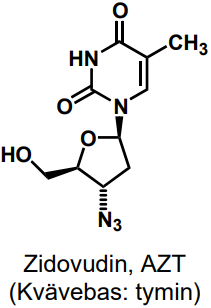 |
Antivirala nukleosidanaloger |
| Indinavir | 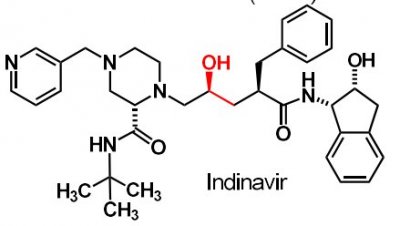 |
Proteashämmare mot HIV |
| Oseltamivir | 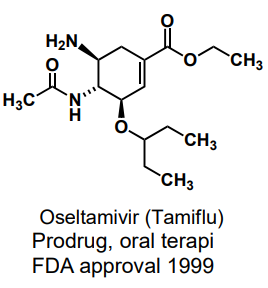 |
Neuraminidashämmare, Mot influensa typ A och B -övergångstillståndsanaloger till oxokarbeniumjon av N-acetylneuraminsyra |
Kapitel 45 (3:e)/ Kapitel 41 (4:e)
Medel mot cancer
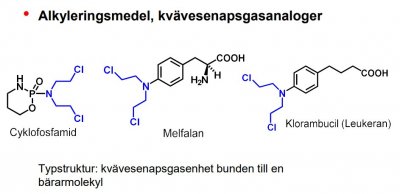
| Cyklofosfamid | 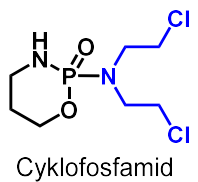 |
Alkyleringsmedel, kvävesenapsgasanaloger Typstruktur: kvävesenapsgasenhet bunden till en |
| Fluorouracil | 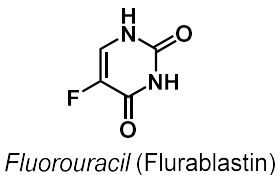 |
Antimetaboliter, nukleosid- och kvävebasanaloger |
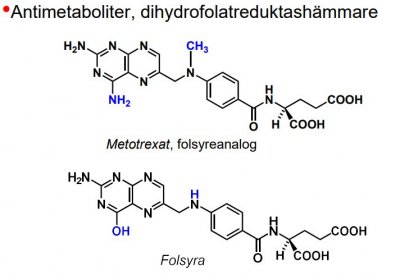
| Metotrexat | 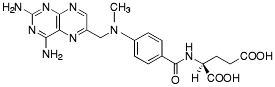 |
|
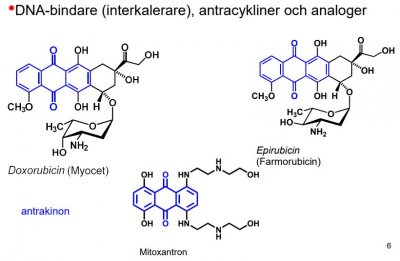
| Mitoxantron | 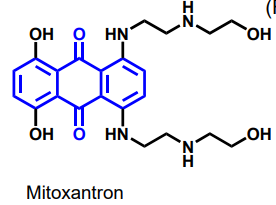 |
DNA-bindare (interkalerare), antracykliner och analoger |
Begreppen och igenkänning av:
Alkyleringsmedel
Elektrofila föreningar som reagerar med nukleofiler, t.ex. guaninkväve i DNA-Dåligt selektivitet, fast snabbt delande cancer celler drabbas hårdast.Ex. senapsgasanaloger
Cytotoxiska medel, binder kovalent till essentiella cellkomponenter, särskilt DNA, och förhindrar därmed fortsatt celldelning.
Antimetaboliter
Analoger till naturliga nukleosider, pyrimidin- och purinbaser, samt co-faktorer som folsyra.
- funkt. direktverkande enzymhämmare (t.ex. metotrexat) eller byggs in i nukleotider och nukleosider och blockerar därefter olika steg i nukleinsyremetabolismen.
DNA- komplexbindare/ interkalerare
Innehåller plana strukturelement som kan inlagras (interkaleras) mellan baserna i DNA. Därigenom stör de DNA:s normala struktur och funktion.
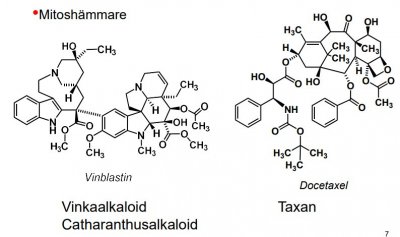
Mitoshämmare
Binder till tubulin (proteinet som bygger upp mikrotubuli i kärnspolen), celldelningen avstannar i metafas.
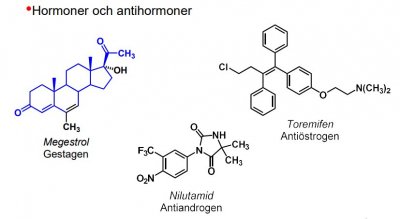
Hormoner och antihormoner
Terapeutiskt utnyttjande tumörers beroende av hormoner vid tillväxt:
- Kirurgiskt avlägsnande av hormonproducerande körtlar
- Farmakoterapeutisk tillförsel av hormoner eller analoger som motverkar ett annat hormon, exv. estrogentillförsel vid prostatacancer
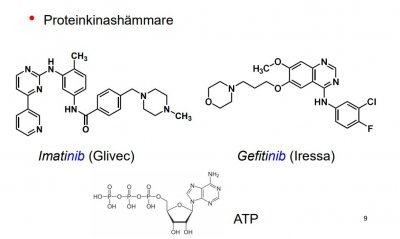
Proteinkinashämmare
Fosforylering (av hydroxigrupperna i serin, treonin och tyrosin, fosfatgruppsdonatorn är ATP) och defosforylering av proteiner, nyckelroll i regleringen av cellens proteiner, "strömbrytare".
Proteinkinaser = katalyserande enzymer.
*Selektiv hämning/inhibition av proteinkinas
-anv. anticancerLM tex. Imatinib och Gefitinib
Kapitel 46 (3:e)/ Kapitel 34 (4:e)
Ögonläkemedel (få LM för lokal beh., men mest framträdande är medel mot glaukom[grön starr])
| Latanoprost | 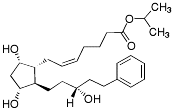 |
Medel mot glaukom Prostaglandiner - är en F(2α)-analog och esterprodrug. Hydroliseras till karboxylsyra (selektiv agonist till prostaglandin F-receptorer) och sänker det intraokulära trycket genom ökning av kammarvattnets avflöde |
Kapitel 47 (3:e)/ Kapitel 42 (4:e)
Protein
Begreppen biotekniska läkemedel/proteinläkemedel
Gemensamt namn: bioteknologi, dvs. sammansmältning av molekylärbiologiska, mikrobiologiska och kemiska metoder, där rekombinanta DNA-tekniker spelar en nyckelroll för att bilda hybrid-DNA. t.ex. humant tillväxthormon, humant insulin, vävnadsplasminogenaktivator (t-PA) och interferoner.
Kapitel 49 (3:e)/ Kapitel 45 (4:e)
Förståelse för saltbildares användning och namn
- korta förenklade generiska namn för saltbildare av INN-typ. Saltnamnen, ofta snarlika esternamn (jmf. natriumacetat-etylacetat)
Begreppen emulgatorer och salvbaser
Emulgator: ytspänningssänkande medel, vätmedel, tvättmedel och komponent i tandkräm ("Irium")
Salvbas: "konsistensgivare", t.ex. destillerad petroleum, d.v.s råolja, och bensin, (paraffin och vaselin, består ffa av alkaner), samt propylenglykol
Kapitel 50 (3:e)/ Kapitel 46 (4:e)
Kursiv läsning rekommenderas!